

重要亮点
● 大约620万美国成年人患有心力衰竭,随着心血管代谢并发症发病率的上升,一部分患者出现左心室射血分数保留的情况。
● 与射血分数降低的心力衰竭不同,后者的循证医学治疗已被证明是有效的,而心血管代谢性HFpEF缺乏基于机制的疗法。
● HFpEF伴随着心肌线粒体功能障碍,氧化应激和代谢不灵活性被认为是其独特发病机制的基础。
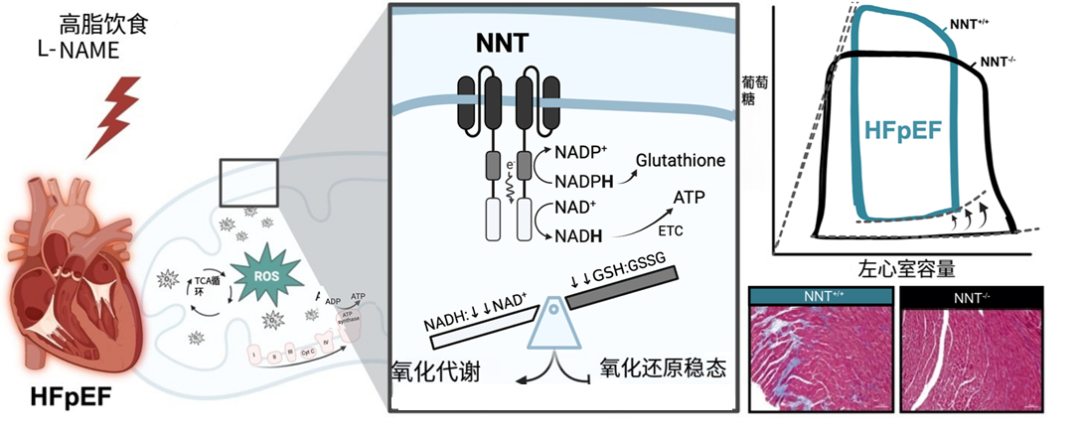
● 通过对NNT(烟酰胺核苷转氢酶)的基因破坏可以保护小鼠模型的心代谢HFpEF中的舒张功能障碍。
● 在C57BL/6J小鼠中,NNT功能丧失可以缓解高脂饮食和L-NAME处理下的烟酰胺腺嘌呤二核苷酸(NAD+)的减少和加速氧化应激。
● 高脂饮食和L-NAME会改变心肌细胞基因表达,导致线粒体氧化代谢中间体显著上调,以及细胞类型特异性富集FGF1受体信号。
研究背景
射血分数保留的心力衰竭(HFpEF)是一种常见的心血管疾病,其特征为心脏舒张功能障碍和左心室僵硬度增加。HFpEF临床预后差,且对大多数指南推荐的射血分数降低的心力衰竭(HFrEF)治疗方案疗效不佳,因此被视为一种独特的临床疾病,需要针对性的治疗方法。
HFpEF的病因复杂多样,与遗传、生活方式和环境因素相关。近年来,研究发现线粒体氧化应激在HFpEF发病发展中发挥重要作用。多种遗传、生活方式和环境因素可能通过破坏线粒体稳态,最终导致HFpEF,并表现出不同于HFrEF的代谢特征。
尽管取得了这些进展,线粒体损伤的机制仍不明确。
研究方法
采用高脂饮食联合Nω-硝基-L-精氨酸甲酯(L-NAME)来诱导小鼠心力衰竭模型,以模拟人类HFpEF的病理生理特征。通过单核转录组分析,发现C57BL/6J小鼠(一种常见的实验小鼠品系)在面对高脂饮食和L-NAME诱导时,心脏舒张功能障碍相对较轻。进一步研究发现,C57BL/6J小鼠的线粒体内膜蛋白Nnt(烟酰胺核苷酸转氢酶)存在功能丧失型突变。将C57BL/6J小鼠的NNT基因突变引入到C57BL/6N背景的小鼠中,构建了Nnt基因缺失(Nnt−/−)和野生型(Nnt+/+)小鼠模型,并对这些小鼠进行高脂饮食和L-NAME诱导。
研究结果
不同品系小鼠在HFpEF诱导中的差异
研究发现,C57BL/6N小鼠在高脂饮食联合L-NAME干预下表现出明显的舒张功能障碍,而C57BL/6J小鼠则未出现这种类似改变。这提示遗传背景是决定小鼠HFpEF表型差异的关键因素。
单核RNA测序分析揭示细胞特异性转录响应
通过单核RNA测序,研究人员发现C57BL/6N小鼠的心肌细胞中与氧化代谢相关的基因表达显著上调,这些基因与冠心病、高血压和心房颤动等HFpEF的风险因素相关。
心脏表型提示NNT依赖性的舒张功能障碍
在高脂饮食和L-NAME诱导下,Nnt+/+小鼠表现出明显的舒张功能障碍和心脏结构重塑,而Nnt−/−小鼠未出现这些病理变化。这表明NNT基因的完整性对于小鼠在高脂饮食和L-NAME诱导下发生HFpEF具有重要作用。
形态学证据显示心肌肥大和纤维化
Nnt+/+小鼠在高脂饮食和L-NAME诱导后表现出显著的心肌肥大和纤维化,而Nnt−/−小鼠则未出现这些变化。同时,Nnt+/+小鼠的NAD+水平下降了40.0%,还原型谷胱甘肽与氧化型谷胱甘肽(GSSG)的比值下降了38.8%。这表明NNT功能丧失能够缓解高脂饮食和L-NAME诱导的氧化应激和代谢紊乱。
NNT依赖性心肌基因表达
通过单核RNA测序和配体-受体分析,研究人员发现成纤维细胞生长因子1(Fgf1)可能是NNT依赖的心肌-成纤维细胞信号分子,进而参与心肌纤维化的进程。
研究结论
本研究揭示了线粒体功能障碍在HFpEF发病机制中的关键作用,并指出NNT和Fgf1可能是治疗HFpEF的新靶点。NNT基因功能缺失可以保护小鼠免受高脂饮食和L-NAME诱导的心脏舒张功能障碍的影响。这些发现为开发针对HFpEF的新疗法提供了重要的科学依据,强调了线粒体氧化还原调节在HFpEF发病过程中的重要性。
参考文献
Pepin ME, Konrad PJM, Nazir S, Bazgir F, Maack C, Nickel A, Gorman J, Hohl M, Schreiter F, Dewenter M, de Britto Chaves Filho A, Schulze A, Karlstaedt A, Frey N, Seidman C, Seidman J, Backs J. Mitochondrial NNT Promotes Diastolic Dysfunction in Cardiometabolic HFpEF. Circ Res. 2025 May 9. doi: 10.1161/CIRCRESAHA.125.326154. Epub ahead of print. PMID: 40340422.